Лидеры в области качества
Руководствуясь миссией заботиться о здоровье людей, группа компаний «НИЖФАРМ» постоянно совершенствует процессы, связанные с контролем и обеспечением качества лекарственных средств, входящих в портфель компании.
В 1963 году в США были сформулированы правила, которые устанавливают требования к организации производства и контроля качества лекарственных средств - GMP (Good Manufacturing Practice, то есть надлежащая производственная практика). Постепенно эти правила распространились на все страны-члены Всемирной организации здравоохранения.
Компания «НИЖФАРМ» была одной из первых в стране, кто внедрил международные стандарты качества фармацевтического производства в практику. Производственная площадка в Нижнем Новгороде стала первым фармацевтическим предприятием в России, которое получило сертификат GMP о соответствии требованиям российского законодательства в 2015 году. Сертификат о соответствии GMP Европейского Союза площадка имеет с 2005 года и постоянно его поддерживает.
Сотрудники производственных площадок группы компаний «НИЖФАРМ» в Нижнем Новгороде и Обнинске обеспечивают контроль качества в течение всего производственного цикла продукта.
Первоначальный контроль начинается с проверки сырья и материалов. Все активные фармацевтические ингредиенты, вспомогательные вещества и упаковочные материалы компания получает от внешних проверенных и одобренных поставщиков. Образцы проходят тестирование в аналитических лабораториях в Нижнем Новгороде и Обнинске в соответствии с утвержденными требованиями регистрационного досье и спецификациями.
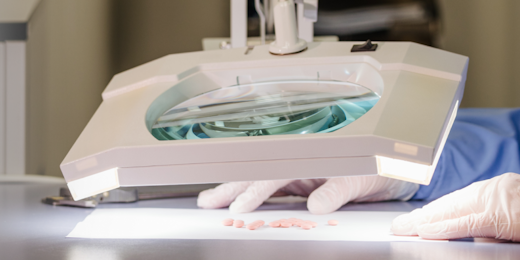
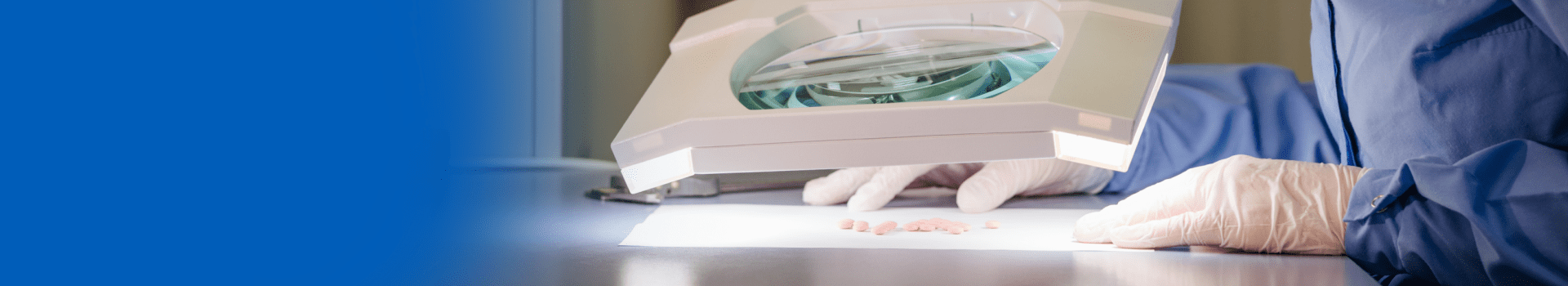
В ходе производства выполняется непрерывный внутрипроизводственный контроль. Его цель — проверка соблюдения всех важных для производства параметров. Это, например, тестирование на остаточную влагу в грануляте, массу таблеток и физические свойства лекарственной формы (например, внешний вид, твердость (таблетки), вязкость (мази, гели), высвобождение активных ингредиентов) и т. д.
Перед тем, как появиться на прилавках аптек каждая выпущенная партия проходит итоговую проверку в лаборатории и утверждение уполномоченного лица о соответствии препарата всем утвержденным требованиям регистрационного досье и спецификациям. Если в ходе проверки было выявлено несоответствие тому или иному параметру, продукт не допускается в коммерческую реализацию. Далее проводится расследование, чтобы выявить и устранить причину, которая привела к выпуску недоброкачественного продукта.
После выхода продукта на рынок компания продолжает следить за «жизнью» препарата, оперативно реагируя на жалобы и претензии потребителей. Выявление ранее неизвестных нежелательных явлений играет очень важную роль в обеспечении качества фармацевтической продукции и защите здоровья пациентов.
Компания продолжает следить за препаратом и в пострегистрационный период, после выхода продукта на рынок, оперативно реагируя на жалобы и претензии потребителя.
Обо всех случаях нежелательных реакций на препараты в портфеле группы компаний «НИЖФАРМ» вы можете сообщить, заполнив «Извещение о побочном действии, нежелательной реакции или отсутствии ожидаемого терапевтического эффекта лекарственного средства» на сайте компании.
Если у вас есть вопросы или пожелания относительно производства, эффективности, качества, покупки и применения препаратов продуктового портфеля нашей компании, воспользуйтесь возможностью задать вопрос через форму Обратной связи внутри конкретного препарата в Каталоге продуктов.
Обо всех неблагоприятных побочных реакциях на препараты из портфеля группы компаний «НИЖФАРМ» вы можете сообщить в разделе Фармаконадзор.
Материалы